肿瘤手术后的再转移要求21世纪的全球抗癌药物研发的战略重点的转移
Cancer metastasis calls for a strategic change of the global anti-cancer drug development in the 21st century
(福州大学化学化工学院,肿瘤转移的预警和预防研究所,福州、福建 350002)
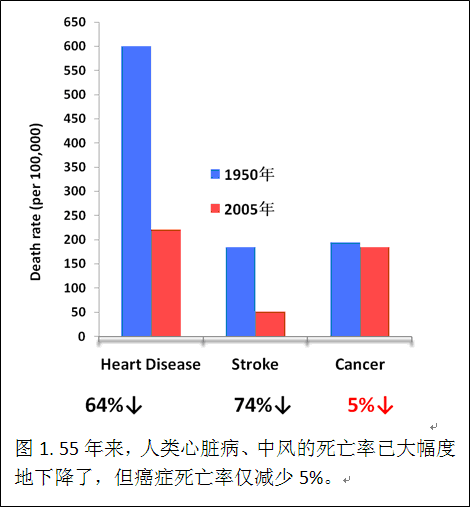
摘要:50多年来,其它重大疾病(心脏病等)的死亡率已经大幅度(>60%)下降了,但是癌症死亡率仅减少约5%,其中绝大多数死于肿瘤转移(图1)。因肿瘤转移造成的死亡是一项全球性的、有关国泰民安的、迫切需要解决的经济、社会、和科技问题。传统的主流“抗癌药”的研发走的是一条“癌症转移后再抗癌”的迟愚路线,收效甚微。目前“有效”的化疗药物并不能有效地控制癌症的转移,且毒副作用大,病人生活品质降低,家属负担剧增。更重要的是,“抗癌药”根本无法逆转肿瘤转移病人的死亡! 把国内外肿瘤治疗的现状和现存缺陷简化一下就是: 早期实体肿瘤可用外科手术切除,其成功率可达95%以上(不用“抗癌药”,除非不能手术!)。到肿瘤转移了外科手术又无法全身一一切除转移的肿瘤块时,“抗癌药”也无效;而肿瘤病人在手术切除后的早期又没有可清除循环肿瘤细胞,和预防将来循环肿瘤细胞的粘附和侵袭的药物,无症状的“病人”只好听天由命,直至3-5年后肿瘤转移发生了。目前仅中美二国就有1000万以上肿瘤手术存活者,各种肿瘤在手术后3-5年内再转移的可能性是30-70%。药物干预肿瘤手术后的再转移是一项被忽略的理论、技术和产品的全球性重大科技空白!不失时机地就此重大的科学和国泰民安的社会问题立项并予实施,可以大规模地降低人类因肿瘤转移造成的死亡,并引领我国在此领域处于国际领先的地位。
关键词:抗癌药;癌症死亡;癌症转移;转移预防;循环肿瘤细胞
因肿瘤转移造成的死亡是全球性的、有关国泰民安的、迫切需要解决的关键经济和科技问题。根据统计分析, 在2010年,美国新发癌症病例预测约为1,529,560例,癌症死亡人数预测为569,490例。在40-85岁的美国人中,癌症是头号杀手[1]。在美国,肿瘤花费以每年15%的速率上升,超过总医保费用的上涨速率[2]。2007年美国的肿瘤费用是$2,192亿,其中直接医疗费用890亿美元,间接损失182亿美元[3,4]。在我国,肿瘤发病率约为200/10万人,每年新发癌症病例在220万以上,癌症死亡人数每年超过160万。肿瘤医疗费用每年在1500亿元以上,是造成我国最佳劳动力损失和医疗费用上涨的主要原因(2010年全国肿瘤大会资料)。肿瘤从1982年以来就是台湾的头号杀手。2008年,台湾平均每6.5分钟就有一人新患肿瘤(台湾卫生部2011年4月报告)。但是50年研发出的“抗癌”化疗药物大体上仅可延缓癌症转移(metastasis)病人5个月的生命!
肿瘤治疗的社会和病人家属的沉重负担——从痛苦到绝望!在美国,医保费用以每年4-5% 的速度上升。2009年,美国的医保花费为$2.5万亿,侵吞了全美国17.6%的国民生产总值(GDP)[2]。其中,肿瘤花费以每年15%的速率上升,超过总医保费用的上涨速率。2007年美国的肿瘤费用是$2,192亿,其中直接医疗费用890亿美元,间接损失182亿美元(疾病造成的低生产率)[3,4]。在欧洲19个国家,仅2004年肿瘤的直接医疗费用就是570亿欧元[5]。据统计,在美国2008年的肿瘤费用的年递增中值是:乳癌,2.7万美元;结肠癌,2.2万美元;前列腺癌,3.4万美元;肺癌,3.2万美元[6]。这一统计强调了目前肿瘤医疗耗费的无效性!治疗HER-2阳性乳癌药Herceptin (trastuzumab)的费用是每年5万美元,肺癌药Gefitinib (Iressa)的费用是每月1,800美元,前列腺癌药Provenge一个月3疗程的费用是9.3万美元[7]。据Kaiser医疗保险公司的统计(www.kff.org/charts/032607.htm),在那些无医保的肿瘤病人中,46%的家庭用去了他们几乎大部分的积蓄,30%的家庭不得不借债,41%的家庭已因治病而付不起基本生活费用。晚期病人往往不堪精神、经济和癌症痛苦的折磨,更主要的是,意识到目前的治疗方案并无回天之力,而选择了提前自我解脱的上天之路!中国某工程院院士在癌症晚期于2010年从高楼跳楼最终解脱了所有的折磨即为一憾例。
1 国内外肿瘤治疗的现状和现存缺陷
1.1 目前“抗癌药”的分类和“抗癌药”在研发和应用上成果甚微
目前肿瘤的化疗药物分为:1)DNA破损剂(DNA damaging agents);2)微管蛋白靶向剂(Tubulin-targeted agents)如紫杉醇等(11);3)拓扑异构酶抑制剂(Topoisomerase inhibitors)如喜树碱, ABT-888[8];4)抗代谢药(Antimetabolites/Nucleosides);5)单克隆抗体;6)表皮生长因子酪氨酸激酶抑制剂如Bcr-abl酪氨酸激酶抑制剂(Gleevec);7)法尼基转移酶抑制剂(Farnesyl transferase inhibitors; FTI);8)蛋白酶小体抑制剂(proteasome inhibitor) ;9)血管内皮生长因子抑制剂; 10)基质金属蛋白酶抑制剂(matrix metalloproteinase inhibitors; MMP);11)环氧化酶-2 (cyclooxygenase-2; COX-2)抑制剂。12)激素类药(Hormonal agents)如Tamoxifen;这类药在离体试验中确实可以造成细胞(癌细胞和正常细胞)死亡。靶向类药[9](Targeted drugs; Signaling agents)仅对少数特殊人种起作用,这些人种的肿瘤需充分表达这种靶蛋白,这样药物才能起作用。这就局限了靶向类药的使用范围。这就是目前“用药个体化(personalized medicine)”口号的起因。靶向类药如新生血管抑制剂bevacizumab的治疗指数(therapeutic index)小,表明此类药也大有不足,包括我们最近参与完成的一项靶向药的联合用药,临床试验表明这些靶向类药对病人产生严重的骨髓抑制[10]。细胞毒类药作用于迅速分裂和繁殖的癌细胞,但也作用于正常消化道上皮细胞、毛发细胞和白细胞。肿瘤细胞对细胞毒类药易产生药物耐受性,这种耐受性可以是内源性的(intrinsic),也可能是获得性的(acquired)[11]。药物耐受性与细胞膜上的外向泵蛋白(efflux pump protein),又称多药耐受性蛋白(multidrug resistance protein)的活性有关,其结构由P-糖蛋白(P-glycoprotein)组成[12-14]。某些癌细胞在化疗药的诱导下也会产生这种多药耐受性蛋白[15]。其它与药物耐受性有关的机制包括beta-III-tubulin isoform[16],我们报道的胞内噬(endocytosis)活性的减弱[17],以及化疗药诱导癌细胞DNA修复的加强[18]。
对1990-2004年的22次的临床试验的结果进行分析,Morgan等发现细胞毒类“抗癌药”仅能使肿瘤病人的5年存活率增加2.1% [19]。同时,这些药物对黑色素瘤、子宫癌、前列腺癌、和肾癌无效。这些抗癌药令人失望的结果归咎于: 药物本身的严重毒性, 病人生活品质下降,自身免疫和康复的能力受到抗癌药的打击,和肿瘤细胞对药物的耐受性。Rustin 等人报道过[20],将卵巢癌病人在紫杉醇治疗后血清癌抗原CA125水平恢复到正常时,随机分成二组,早期化疗组和延迟化疗组。早期化疗组(265人)和延迟化疗组(264人)的存活期中值分别是25.7月和27.1月,二组存活期中值无显著差异。早期化疗组病人的存活期中值反而缩短二个月,提示药物对人的毒副作用。凡此种种败例多不胜举[21-23],包括我们在美国国立卫生研究院/国家癌症研究所(National Institutes of Health /National Cancer Institute)主持和/或参与完成的多项抗癌药的临床前研发,皆因对人的毒副作用而败北在临床[24-28]。目前所用的抗癌药对休眠癌细胞无效,如Doxorubicin 对注射到小鼠体内的休眠期长的鼠乳癌细胞无效[29,30]。
1.2 “抗癌药”无法阻挡晚期癌细胞的转移和扩散且毒副作用大
早期肿瘤病人,如肠癌病人I期的外科手术痊愈率可达到>90%。II和III期肠癌病人在手术切除后的5年存活率为25-85%。在手术切除肿瘤后,医生往往给予II和III期病人短期化疗药物,以为这样可以避免以后的肿瘤转移。这种模式已经使用了30多年未见成效,原因在于:1) 手术后CTCs数量急剧下降,化疗药物仅仅作用于迅速分裂和增长的肿瘤细胞,手术后的CTCs往往处于静止状态,此时用化疗药利少弊多;2)化疗药物不能选择性地杀死CTCs;相反,化疗药物却打击了人的自身免疫系统,包括NK cells、T-cells,使“疾病─人体自身抗病力”之间的平衡朝着不利方面倾斜,甚至引起致突变、致癌;3) 化疗药物作用于迅速分裂和增长的肿瘤细胞, 而不是作用于我们今天认识的肿瘤转移的几个关键位点上。
肿瘤化疗有时可引起炎症反应[31]。这主要是放射疗法或化疗可引起肿瘤细胞凋亡并影响到其边缘细胞和组织,随之而来的是类似伤口痊愈过程的那种炎症反应[32]。肿瘤化疗引起炎症反应的利弊综合效果尚有争论:一方面,它可由于细胞凋亡而引起肿瘤细胞迅速增长[33,34];另一方面,它抑制现存的肿瘤,增加肿瘤抗原的交叉存在和引起后续的肿瘤免疫反应[35]。
50多年来,经NCI数据库记录在案的筛选过的745,000化合物中, 80,000进入动物试验筛选, 仅80个被FDA 批准上市, 但是这些上市药还是不能抑制肿瘤转移。Iressal 和Erlotinib 就是根据以上传统的抗癌药物筛选模型筛选的最有成药性的Tyrosine Kinase Inhibitors: IC50<10 nm; 50 mg/kg/day, po,可完全抑制裸鼠身上的人肿瘤细胞的生长, 药效高于doxorubicin[36]。但是2009年9月FDA停止了二药临床试验, 原因是毒副作用和对病人无效。新生血管抑制剂bevacizumab (Avastin®)可抑制肿瘤的新生血管,但对肿瘤的转移无效,与其它抗癌药合并也不显示有效性,而且副作用大,现已从一线抗乳腺癌药中撤下(http://www.cancer.gov/cancertopics/druginfo/fda-bevacizumab)。
1.3 荷瘤裸鼠模型与临床治疗的实际脱节
各国在筛选抗癌药物时所用的动物模型几乎都是采用人肿瘤细胞种植裸鼠,包括我们自己在以往所完成的“抗癌药”研发[17,27,37-39]。这种裸鼠模型于1969年第一次报道。但该模型在免疫学、治疗学和药物靶向等多方面与人的肿瘤转移的预防和治疗相差甚远[40]:1)因为人癌细胞与裸鼠皮下基质(stroma)的异源性以及人癌细胞与种植组织的异位性(如人的肠癌细胞异位种植在裸鼠皮下),种植的人肿瘤细胞株难以浸润和通过异种荷瘤鼠的皮下组织,形成肿瘤转移。2)裸鼠缺乏Foxn1nu基因,而无胸腺。因此不能产生T细胞(包括D4+,CD8+),无免疫反应。无免疫反应正是这种裸鼠可荷瘤的前提,但也是这种裸鼠无法显示“药物-肿瘤-免疫反应系统”相互作用的一大遗憾!3)这种裸鼠用于筛药时有二项通过指标:1.荷瘤给药组的瘤体积必须小于对照组40%;2. 荷瘤给药组的生命期比对照组延长至少25%。但实体瘤病人首选手术切除肿瘤而不是服药后试看肿瘤是否缩小,因此这一模型与临床实际脱离。4)每一个药厂筛选的药物仅针对一个靶点,独霸一个专利,而肿瘤转移必须联合用药,以综合治理肿瘤转移的关键位点。以上种种原因造成了肿瘤药物治疗在40年中进展缓慢。
阴阳平衡强调的是生物体的正常生理活动和异常病变与外界的相互影响。阴和阳是矛盾的统一,两者相互依存,不可分割[41]。人体多有自生自灭的肿瘤微灶[42]。正常情况下,肿瘤微灶和宿主的免疫系统保持相互制约平衡,而不显疾病。在不健康的情况下,这种平衡被局部破坏,肿瘤微灶突破制约而发展。化疗药在抑制肿瘤的同时,往往由于药物本身的毒副作用而打击了人体的自身康复功能(包括NK cells, T-cells)使“疾病─人体自身抗病力”之间的动态平衡朝着不利方面倾斜, 甚至引起致突变、致癌。“痊愈”一词表明患者已完全恢复到疾病前的阴阳平衡。而化疗药有时加重肿瘤带来的阴阳失衡,使痊愈变得几乎不可能了!
把国内外肿瘤治疗的现状和现存缺陷简化一下就是: 早期实体肿瘤可用外科手术切除,其成功率可达95%以上(不用“抗癌药”,除非不能手术!)。到肿瘤转移了外科手术又无法全身一一切除转移的肿瘤块时,“抗癌药”也无效;而肿瘤病人在手术切除后的早期又没有可清除CTCs,和预防将来CTCs的粘附和侵袭的药物,无症状的“病人”只好等待,直致3-5年后肿瘤转移发生了,病人只好“坐守待毙”。这就是当今肿瘤药物治疗的一个全球性的方向性错误和技术缺陷! 以上事实充分说明了当前传统的“抗癌药”研发的方向性错误: 筛选使肿瘤缩小的细胞毒的药物、或靶向药,以为这样可以制止或逆转癌细胞的转移和扩散,而不是研发可提早预防和抑制肿瘤转移的非细胞毒的药物。
2 肿瘤的转移
90%以上的肿瘤病人死于肿瘤转移而不是原发性肿瘤。原发性肿瘤在手术切除后的5年内是癌症转移、扩散的高风险期[43,44]。其间,由休眠(dormant) 无活性转为具有活性的CTCs可在血中通过粘附血管内膜、侵润或外渗、形成肿瘤转移的微灶、直至肿瘤全面转移扩散。人原发性肿瘤均采取外科手术切除。如果肿瘤未转移,循环肿瘤细胞可与手术切除后的患者共存10年、甚至20年之久[45,46]。但是,肿瘤一旦转移扩散,无药可以专一性地制止和逆转癌细胞在体内的扩散。这就像防止白蚁群对一豪宅的侵犯一样, 有效的防治法是把白蚁诱杀于萌芽。一旦白蚁群侵入了豪宅的各个器官,那就到了防不胜防的晚期。根据癌症晚期死亡病人的病理解剖分析[47,48],癌细胞转移到病人的各个组织器官(包括肺、胸膜、腹膜、肝、骨、胰腺、脾、皮肤、胃肠道、脑、心、心包、肾上腺、甲状腺、肾、卵巢、子宫)几乎是一种必然。例如,乳癌患者在手术后3年内的再复发几率是40% [49]。据2万以上结肠癌患者的术后统计,2期和3期结肠癌患者手术后3年内的再复发率分别是74%和82% [50]。在外科手术切除原发性实体肿瘤(肺癌、肠癌、乳腺癌和前列腺癌)后的1-5年,一旦肿瘤转移,90%以上的病人仍将痛苦地死于肿瘤转移,而不是原发性肿瘤[51,52]。无数癌症患者已经经历或正在经历肿瘤转移这一过程的无情事实,充分证明了肿瘤转移在肿瘤演变中的必然性,以及发现和消除肿瘤转移在癌症治疗中的重要性。但是,要研究肿瘤转移机制,发现和抑制肿瘤的转移,其难度之大,进程之慢,奥秘之深和结果之不可预测性,却一直困扰着资深的遗传学家、生物学家和医学家,乃至于所有的科学家。直到现在,几乎所有肿瘤的治疗,仍然是建立在传统的肝癌治肝,肺癌治肺;建立在高投入和不可预测性的“定向治疗”的盲点上。科学家还没有有效的方法,发现和消除肿瘤转移的隐患;还没有有效的方法,能在特定的时间内,对肿瘤转移的患者,科学地、有把握地进行治疗。总之,只有发现和消除肿瘤转移的隐患才能极大地延长癌症患者的生命,提高癌症患者的生活质量,乃至使癌症患者完全痊愈。因此,发现和消除肿瘤转移的隐患应该是癌症根治中最有前途,最有希望的方法。如果这一研究领域取得突破,那不管是对科学,或是对癌症治疗,都将是里程碑式的贡献,至少将再次极大地推动癌症治疗方法与思路的飞跃发展,其意义不言而喻。因此世界各国科学家对这一研究领域给予了极度的关注。尽管要揭开这一科学的神秘面纱,困难很大,道路很长,但进展不断,科学家乐此不疲!
3 肿瘤转移的药物干预:一项原创性的探索
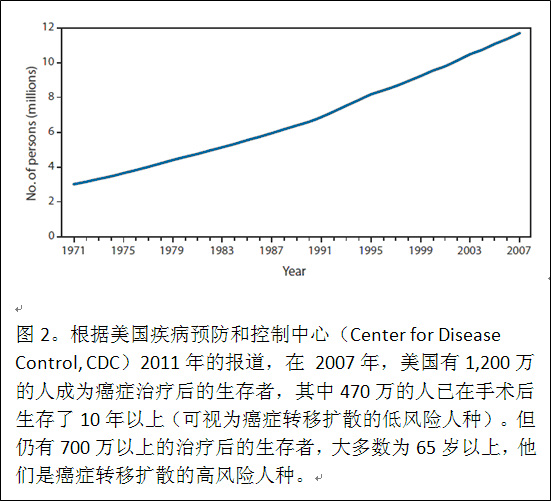
根据美国疾病预防和控制中心(Center for Disease Control, CDC)2011年的报道(CDC Weekly 60(09); 269-272, 2011),在2007年,美国有1,200万的人成为癌症治疗后的生存者,其中470万的人已在手术后生存了10年以上(可视为癌症转移扩散的低风险人种)。但仍有700万以上的治疗后的生存者,大多数为65岁以上,他们是癌症转移扩散的高风险人种(图2)。中国在治患者600万以上。对这上千万以上的肿瘤手术后的生存者来说,即使再复发机率是10%,而再复发又意味着肿瘤的转移扩散,这也够肿瘤患者在手术后担忧和恐惧的!
肿瘤转移研究与相关的药物筛选模型是一项被遗漏(或较难)的研究工作,目前尚无常规示范模式可仿效。2003年NCI批准的8900项与肿瘤有关grants中, 92%未提到肿瘤转移(metastasis)一词[53]。学科间的不沟通是失败的另一原因:抗癌药物的研发需要跨学科协调和跨学科知识互补。跨学科协调和跨学科知识互补链的断裂, 使得搞肿瘤转移研究的人错误地用非特异性的化疗药物研究肿瘤转移, 搞肿瘤药物筛选动物模型的人不知道肿瘤转移有几个关键位点,搞肿瘤药物合成的人不知道动物模型和病人的药物治疗,因此预防肿瘤转移的药物的研发一直处于理论、技术和产品的全球性空白。
尽管目前抗癌药物Gleevec (Imatinib),Sprycel已可控制血癌(淋巴瘤lymphoma和白血病leukemia),并使血癌病人的存活率达到90%[54],但人类在控制和逆转肿瘤转移上进展甚微,难以突破。人类控制血癌的成功给了我们一个极大的启迪:肿瘤转移病人是否象血癌病人一样,因为发生22号染色体与9号染色体的错位(Philadelphia染色体),形成了一个致癌基因BCR-ABL,最终导致血细胞中形成一种异常的酪氨酸激酶(Tyrosine Kinase)BCR-ABL蛋白?如果一样,那就意味着肿瘤转移病人的CTCs表面理所当然具有某种可识别的表面抗原,肿瘤转移病人也能够通过象血癌病人抑制酪氨酸激酶(Tyrosine Kinase)BCR-ABL蛋白的活性一样,通过抑制和消除CTCs来阻断肿瘤的转移。我们正在研究这种可敏感识别CTCs表面蛋白的抗体络合物,力求在血中(而不是肿瘤组织)反复寻找和俘获CTCs,结合和抑制CTCs并使之失活,并将这种结合物逐渐排出体外,以达到彻底消除病人手术后肿瘤再转移的隐患。如果这一设想成功,我们可显著降低人类因肿瘤转移造成的死亡,产生重大的社会和科学问题的突破!
References
[1] Jemal A, Siegel R, Xu J, et al. Cancer statistics, 2010 [J]. CA Cancer J Clin, 2010, 60: 277-300.
[2] Konski A. The war on cancer: progress at what price? [J]. J Clin Oncol, 2011, 29: 1503-1504.
[3] Bach PB. Costs of cancer care: a view from the centers for Medicare and Medicaid services [J]. J Clin Oncol, 2007, 25: 187-190.
[4] Bach PB. Limits on Medicare's ability to control rising spending on cancer drugs [J]. N EnglJ Med, 2009, 360: 626-633.
[5] Jönsson BW. The burden and cost of cancer [J]. Ann Oncol, 2007, 18: iii8-iii22.
[6] Greenberg D, Earle C, Fang CH, et al. When is cancer care cost-effective? A systematic overview of cost-utility analyses in oncology [J]. J Natl Cancer Inst, 2010, 102: 82-88.
[7] Shih YC, Halpern MT. Economic evaluations of medical care interventions for cancer patients: how, why, and what does it mean? [J]. CA Cancer J Clin, 2008, 58: 231-244.
[8] Goss PE, Chambers AF. Does tumour dormancy offer a therapeutic target? [J]. Nat Rev Cancer,2010, 10: 871-877.
[9] Sawyers C. Targeted cancer therapy [J]. Nature, 2004, 432: 294-297.
[10] Kummar S, Chen A, Ji J, et al. Phase I study of PARP inhibitor ABT-888 in combination with topotecan in adults with refractory solid tumors and lymphomas [J]. Cancer Res, 2011, 71: 5626-5634.
[11] Leonessa F, Clarke R. ATP binding cassette transporters and drug resistance in breast cancer [J]. Endocr Relat Cancer, 2003, 10: 43-73.
[12] Liu H, Liu X, Jia L, et al. Insulin therapy restores impaired function and expression of P-glycoprotein in blood-brain barrier of experimental diabetes [J]. Biochem Pharmacol, 2008, 75: 1649-1658.
[13] Jia L. Liu X. The conduct of drug metabolism studies considered good practice (II): in vitro experiments [J]. Curr Drug Metab, 2007, 8: 822-829.
[14] Jia L, Gu Y, Zeng E., et al. Pharmacokinetics of LJP 993, a tetrameric conjugate of domain 1 of beta2-glycoprotein I for antiphospholipid syndrome [J]. Lupus, 2010, 19: 130-137.
[15] Longley DB, Johnston PG. Molecular mechanisms of drug resistance [J]. J Pathol, 2005, 205: 275-292.
[16] Mozzetti S, Ferlini C. Concolino P, et al. Class III beta-tubulin overexpression is a prominent mechanism of paclitaxel resistance in ovarian cancer patients [J]. Clin Cancer Res, 2005, 11: 298-305.
[17] Liang XJ, Meng H, Wang Y, et al. Metallofullerene nanoparticles circumvent tumor resistance to cisplatin by reactivating endocytosis [J]. P Natl Acad Sci USA, 2010, 107: 7449-7454.
[18] Siddik ZH. Cisplatin: mode of cytotoxic action and molecular basis of resistance [J]. Oncogene, 2003, 22: 7265-7279.
[19] Morgan G, Ward R, Barton M. The contribution of cytotoxic chemotherapy to 5-year survival in adult malignancies [J]. Clin Oncol (R Coll Radiol), 2004, 16: 549-560.
[20] Rustin G J, van der Burg ME, Griffin CL, et al. Early versus delayed treatment of relapsed ovarian cancer (MRC OV05/EORTC 55955): a randomised trial [J]., Lancet, 2010, 376: 1155-1163.
[21] Saltz LB, Cox JV, Blanke C, et al. Irinotecan plus fluorouracil and leucovorin for metastatic colorectal cancer. Irinotecan Study Group [J]. N EnglJ Med, 2000, 343: 905-914.
[22] Ellis P, Barrett-Lee P, Johnson L, et al. Sequential docetaxel as adjuvant chemotherapy for early breast cancer (TACT): an open-label, phase III, randomised controlled trial [J]. Lancet, 2009, 373: 1681-1692.
[23] Ramsey SD, Moinpour CM, Lovato LC, et al. Economic analysis of vinorelbine plus cisplatin versus paclitaxel plus carboplatin for advanced non-small-cell lung cancer [J]. J Natl Cancer Inst, 2002, 94: 291-297.
[24] Jia L, Schweikart K, Tomaszewski J, et al. Toxicology and pharmacokinetics of 1-methyl-d-tryptophan: absence of toxicity due to saturating absorption [J]. Food Chem Toxicol, 2008, 46: 203-211.
[25] Jia L, Coward LC, Kerstner-Wood CD, et al. Comparison of pharmacokinetic and metabolic profiling among gossypol, apogossypol and apogossypol hexaacetate [J]. Cancer Chemother Pharmacol, 2008, 61: 63-73.
[26] Reid JM, Buhrow SA, Kuffel M J, et al. Pharmacokinetics, pharmacodynamics and metabolism of the dimeric pyrrolobenzodiazepine SJG-136 in rats [J]. Cancer Chemother Pharmacol, 2011, 68: 777-786.
[27] Kitada S, Kress CL, Krajewska M, et al. Bcl-2 antagonist apogossypol (NSC736630) displays single-agent activity in Bcl-2-transgenic mice and has superior efficacy with less toxicity compared with gossypol (NSC19048) [J]. Blood, 2008, 111: 3211-3219.
[28] Jia L, Gorman GS., Coward LU, et al. Preclinical pharmacokinetics, metabolism, and toxicity of azurin-p28 (NSC745104) a peptide inhibitor of p53 ubiquitination [J]. Cancer Chemother Pharmacol, 2011, 68: 513-524.
[29] Naumov GN, Townson JL, MacDonald IC, et al. Ineffectiveness of doxorubicin treatment on solitary dormant mammary carcinoma cells or late-developing metastases [J]. Breast Cancer Res Treat, 2003, 82: 199-206.
[30] Townson JL, Ramadan SS, Simedrea C, et al. Three-dimensional imaging and quantification of both solitary cells and metastases in whole mouse liver by magnetic resonance imaging [J]. Cancer Res, 2009, 69: 8326-8331.
[31] Grivennikov SI, Greten FR, Karin M. Immunity, Inflammation, and Cancer [J]. Cell, 2010, 140: 883-899.
[32] Zong WX, Thompson CB. Necrotic death as a cell fate [J]. Gene Dev, 2006, 20: 1-15.
[33] Ammirante M, Luo JL, Grivennikov S, et al. B-cell-derived lymphotoxin promotes castration-resistant prostate cancer [J]. Nature, 2010, 464: 302-305.
[34] Vakkila J, Lotze MT. Inflammation and necrosis promote tumour growth [J]. Nature reviews. Immunology, 2004, 4: 641-648.
[35] Zitvogel L, Apetoh L, Ghiringhelli F, et al. Immunological aspects of cancer chemotherapy [J]. Nature reviews. Immunology, 2008, 8: 59-73.
[36] Arora A, Scholar EM. Role of tyrosine kinase inhibitors in cancer therapy [J]. J Pharmacol Exp Ther, 2005, 315: 971-979.
[37] Jia L. Garza M, Wong H, et al. Pharmacokinetic comparison of intravenous carbendazim and remote loaded carbendazim liposomes in nude mice [J]. J Pharm Biomed Anal, 2002, 28: 65-72.
[38] Shami PJ, Saavedra JE, Bonifant CL, et al. Antitumor activity of JS-K [O2-(2,4-dinitrophenyl) 1-[(4-ethoxycarbonyl)piperazin-1-yl]diazen-1-ium-1,2-diolate] and related O2-aryl diazeniumdiolates in vitro and in vivo [J]. J Med Chem, 2006, 49: 4356-4366.
[39] Kiziltepe T, Anderson KC, Kutok JL, et al. JS-K has potent anti-angiogenic activity in vitro and inhibits tumour angiogenesis in a multiple myeloma model in vivo [J]. J Pharm Pharmacol, 2010, 62: 145-151.
[40] Frese KK, Tuveson DA. Maximizing mouse cancer models [J]. Nat Rev Cancer, 2007, 7: 645-658.
[41] Jia L, Zhao Y, Liang XJ. Current evaluation of the millennium phytomedicine- ginseng (II): Collected chemical entities, modern pharmacology, and clinical applications emanated from traditional Chinese medicine [J]. Curr Med Chem, 2009, 16: 2924-2942.
[42] Esserman L, Shieh Y, Thompson I. Rethinking screening for breast cancer and prostate cancer [J]. J Am Med Assoc, 2009, 302: 1685-1692.
[43] Demicheli R, Abbattista A, Miceli R, et al. Time distribution of the recurrence risk for breast cancer patients undergoing mastectomy: further support about the concept of tumor dormancy [J]. Breast Cancer Res Treat, 1996, 41: 177-185.
[44] Karrison TG, Ferguson DJ, Meier P. Dormancy of mammary carcinoma after mastectomy [J]. J Natl Cancer Inst, 1999, 91: 80-85.
[45] Meng S, Tripathy D, Frenkel EP, et al. Circulating tumor cells in patients with breast cancer dormancy [J]. Clin Cancer Res, 2004, 10: 8152-8162.
[46] Naumov GN, MacDonald IC, Chambers AF, et al. Solitary cancer cells as a possible source of tumour dormancy? [J]. Semin Cancer Biol, 2001, 11: 271-276.
[47] Lee YT. Breast carcinoma: pattern of metastasis at autopsy [J]. J Surg Oncol, 1983, 23: 175-180.
[48] Bidard FC, Vincent-Salomon A, Sigal-Zafrani B, et al. Prognosis of women with stage IV breast cancer depends on detection of circulating tumor cells rather than disseminated tumor cells [J]. Ann Oncol, 2008, 19: 496-500.
[49] Tamoxifen for early breast cancer: an overview of the randomised trials. Early Breast Cancer Trialists' Collaborative Group Tamoxifen for early breast cancer: an overview of the randomised trials [J]. Lancet, 1998, 351: 1451-1467.
[50] Sargent DJ, Patiyil S, Yothers G, et al. End points for colon cancer adjuvant trials: observations and recommendations based on individual patient data from 20,898 patients enrolled onto 18 randomized trials from the ACCENT Group [J]. J Clin Oncol, 2007, 25: 4569-4574.
[51] Sethi N, Kang Y. Unravelling the complexity of metastasis — molecular understanding and targeted therapies [J]. Nat Rev Cancer, 2011, 11: 735-748.
[52] Hanahan D, Weinberg RA. Hallmarks of cancer: the next generation [J]. Cell, 2011, 144: 646-674.
[53] Leaf C. Why we're losing the war on cancer (and how to win it) [J]. Fortune, 2004, 149: 76-82, 84-76, 88 passim.
[54] Goldstein JL. Lasker Awards and papal portraiture: turning fields upside down [J]. Nat Med, 2009, 15: 1137-1140.

